Indhold
- etaper
- Metode 1 Lær reglerne for opløselighed
- Metode 2 Brug en mnemonic: NAG SAG
- Metode 3 Det grundlæggende i læring
En forbindelses opløselighed er dens evne til at opløses i vand. En uopløselig forbindelse danner et bundfald i opløsning. En delvis opløselig forbindelse siges også at være kemisk uopløselig. Hvis du husker reglerne om opløselighed, vil det gøre dit liv lettere, når du skal arbejde med kemiske ligninger. Med lidt tid, arbejde og nogle mnemoniske tricks, vil du huske alle formlerne.
etaper
Metode 1 Lær reglerne for opløselighed
-

Salte af gruppe 1A er opløselige. Den periodiske tabel med elementer er organiseret i rækker og kolonner kaldet henholdsvis "perioder" og "grupper". Den første kolonne i tabellen indeholder elementerne i gruppe 1A. Det er alkaliske metaller. Disse inkluderer elementerne Li, Na, K, Cs og Rb.- Eksempel: KCl og LiOH er opløselige i vand.
-

Salte af nitrater, chlorater og acetater er opløselige. Når nitrat (med formlen NO3), chlorat (ClO-formel3) eller lacetat (med formlen CH3COO) danner salte, de bliver opløselige i vand.- Eksempel: KNO3NaClO3 og CH3COONa er alle opløselige.
-

Alle ammoniumsalte er opløselige. Ammonium løve (NH-formel4) danner salte, der adskilles fuldstændigt i vand. Der er ingen undtagelse fra denne regel.- Eksempel: NH4OH er opløselig, selvom det indeholder en hydroxidion.
-
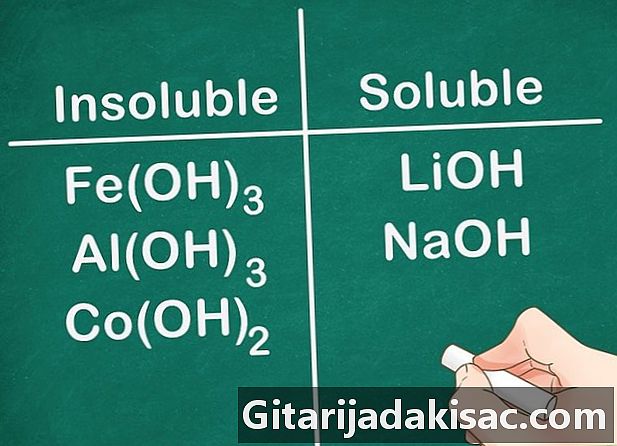
De fleste hydroxylforbindelser er uopløselige. Nogle hydroxidsalte er let opløselige. Dette er tilfældet med hydroxider dannet med gruppe 2-elementer (Ca, Sr og Ba). Hydroxidsalte dannet med gruppe 1-elementer er en undtagelse, fordi disse elementer stadig er opløselige.- Eksempel: Fe (OH)3, Al (OH)3 og Co (OH)2 er uopløselige, men LiOH og NaOH er opløselige.
-

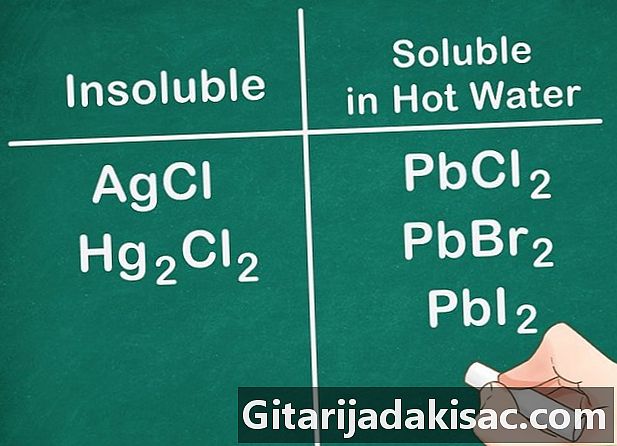
Ikke-metal-salte i gruppe 17 er generelt opløselige. Ikke-metaller i gruppe 17 inkluderer klor (Cl), bromid (Br) og liode (I). Penge, bly og kviksølv er undtagelser fra denne regel. Forbindelserne bestående af disse ikke-metaller og disse ioner er ikke opløselige.- Eksempel: AgCl og Hg2cl2 er begge uopløselige.
- PbCl2, PbBr2 og PbI2 er opløselige i MEGET VARMT vand.
-
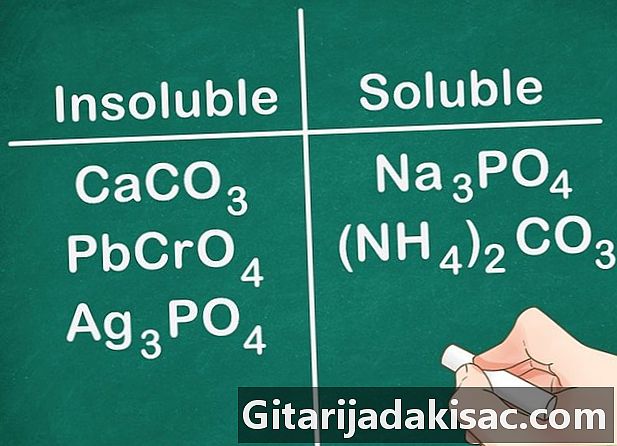
De fleste carbonater, kromater og fosfater er uopløselige. De kemiske formler for disse elementer er: CO3 (carbonater), CrO4 (kromater) og PO4 (Phosphater). Gruppe 1A metaller og NH-forbindelser4 en undtagelse og er opløselige.- Eksempel: forbindelser såsom CaCO3, PbCrO4 og Ag3PO4 er alle uopløselige, hvorimod forbindelser som Na3PO4 og (NH4)2CO3 er opløselige.
-
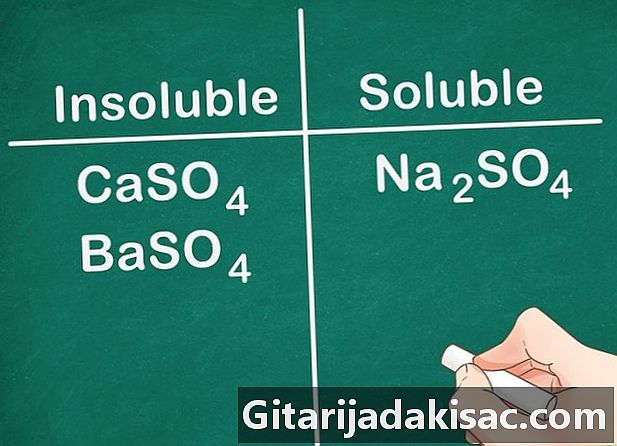
De fleste af sulfatsalte er opløselige. De fleste salte inklusive en SO-ion4 er opløselig i vand. Ca, Ba, Pb, Ag, Sr og Hg er undtagelser fra denne regel. Sulfatsalte indeholdende disse ioner er ikke opløselige.- Eksempel: Na2SO4 er helt opløselig, mens CaSO4 og BaSO4 er ikke opløselige.
-

Størstedelen af svovlforbindelserne er uopløselige i vand. Barium, calcium, magnesium, natrium, kalium og ammonium er undtagelser fra denne regel. Kun forbindelser fremstillet af disse elementer og sulfid er opløselige i vand.- Eksempel: CdS, FeS og ZnS er alle uopløselige.
- Imidlertid er overgangsmetalsulfider uopløselige.
Metode 2 Brug en mnemonic: NAG SAG
-

Brug den mnemoniske NAG SAG-mnemonikken. Lacronyme NAG SAG er et let trick at huske opløselige forbindelser og undtagelser. Skriv navnet NAG SAG, og husk betydningen af hvert bogstav. Denne teknik udelukker ikke alle opløselighedsregler, men dækker en god del af dem. Alle bogstaver repræsenterer opløselige molekyler.- N: Nitrater (NO3)
- A: Acetater (CH3COO)
- G: Alkalimetaller i gruppe 1 (Li, Na osv.)
- S: Sulfater (SO4)
- A: Ammoniumioner (NH4)
- G: ikke-metaller fra gruppe 17 (F, Cl, Br, I osv.)
-

Husk PMA-navnet til den første undtagelse. P repræsenterer Pb (bly). M repræsenterer kviksølv (Hg2). A repræsenterer sølv (Ag). Disse tre ioner er aldrig opløselige med sulfatgruppen eller ikke-metaller fra gruppe 17.- Når du bemærker det mnemoniske trick, skal du tegne en stjerne i nærheden af PMA-forkortelsen og en lignende stjerne nær SG og S for at minde dig om, at de er undtagelser.
-

Husk ordene "Castro" og "bar" til den anden undtagelse. Det lyder måske dumt, men disse ord hjælper dig med at huske calciumioner (Ca, strontium (Sr) og barium (Ba).) Disse tre ioner er aldrig opløselige med sulfater.- Lav et kryds ved siden af disse ord og et andet kryds nær S af SAG for at huske, at disse ioner er undtagelserne for opløseligheden af sulfat.
Metode 3 Det grundlæggende i læring
-

Gennemgå ofte. At huske information tager altid tid og arbejde. Jo mere du læser dine lektioner, jo mere vil du huske på lang sigt. Gennemgå reglerne ofte, og test dig selv dagligt om emnet.- Bed venner eller familie til at stille dig spørgsmål om dette emne til frokost eller middag.
- Opbevar en kopi af reglerne til rådighed til gennemgang, når du har lidt fritid.
-

Lav oversigtsark og brug dem. Kortene er et fremragende medium til hurtigt at revidere et emne og huske det. Bemærk opløselighedsreglerne på kort med nogle eksempler. Gennemgå arkene, indtil du er bekendt med reglerne og navnene på forbindelser, der er opløselige og uopløselige.- Tag dine kort med dig, og tag dem ud for at gennemgå i bilen eller mens du venter på dine venner.
- Alle muligheder er gode til at gennemgå dine fortegnelser.
-

Brug mnemoniske midler. De mnemoniske værktøjer er tip, der hjælper dig med at huske information hurtigt og nemt. Når du lærer et mnemonisk udtryk, kan det være nyttigt at skrive det flere gange for at huske det. De mnemoniske tricks er kun nyttige, hvis du ved, hvad hvert bogstav betyder!- Øv dig på at skrive akronymer, og hvad hvert bogstav betyder.
- Når du er under gennemgang, skal du først bemærke de mnemoniske tip til fremtidig reference.